Núcleo atómico
El núcleo atómico es la parte central de un átomo, tiene carga positiva, y concentra más del 99,9% de la masa total del átomo.
Está formado por protones y neutrones (denominados nucleones) que se mantienen unidos por medio de la interacción nuclear fuerte, la cual permite que el núcleo sea estable, a pesar de que los protones se repelen entre sí (como los polos iguales de dos imanes). La cantidad de protones en el núcleo (número atómico), determina el elemento químico al que pertenece. Los núcleos atómicos no necesariamente tienen el mismo número de neutrones, ya que átomos de un mismo elemento pueden tener masas diferentes, es decir son isótopos del elemento.
La existencia del núcleo atómico fue deducida del experimento de Rutherford, donde se bombardeó una lámina fina de oro con partículas alfa, que son núcleos atómicos de helio emitidos por rocas radiactivas. La mayoría de esas partículas traspasaban la lámina, pero algunas rebotaban, lo cual demostró la existencia de un minúsculo núcleo atómico.
Historia
El descubrimiento de los electrones fue la primera indicación de la estructura interna de los átomos. A comienzos del siglo XX el modelo aceptado del átomo era el de JJ Thomson "pudín de pasas" modelo en el cual el átomo era una gran bola de carga positiva con los pequeños electrones cargados negativamente incrustado dentro de la misma. Por aquel entonces, los físicos habían descubierto también tres tipos de radiaciones procedentes de los átomos : alfa, beta y radiación gamma. Los experimentos de 1911realizados por Lise Meitner y Otto Hahn, y por James Chadwick en 1914 mostraron que el espectro de decaimiento beta es continuo y no discreto. Es decir, los electrones son expulsados del átomo con una gama de energías, en vez de las cantidades discretas de energía que se observa en rayos gamma y decaimiento alfa. Esto parecía indicar que laenergía no se conservaba en estos decaimiento. Posteriormente se descubrió que la energía sí se conserva, con el descubrimiento de los neutrinos.
En 1906 Ernest Rutherford publicó "El retraso de la partícula alfa del radio cuando atraviesa la materia", en Philosophical Magazine (12, p. 134-46). Hans Geiger amplió este trabajo en una comunicación a la Royal Society (Proc. Roy. Soc. 17 de julio de 1908) con experimentos y Rutherford se había hecho pasar aire a través de las partículas α, papel de aluminio y papel de aluminio dorado. Geiger y Marsden publicaron trabajos adicionales en 1909 (Proc. Roy. Soc. A82 p. 495-500) y ampliaron aún más el trabajo en la publicación de 1910 por Geiger (Proc. Roy. Soc. 1 de febrero de 1910). En 1911-2 Rutherford explicó ante la Royal Society los experimentos y propuso la nueva teoría del núcleo atómico. Por lo que se considera que Rutherford demostró en 1911 la existencia del núcleo atómico.1
Por esas mismas fechas (1909) Ernest Rutherford realizó un experimento en el que Hans Geiger y Ernest Marsden, bajo su supervisión dispararon partículas alfa (núcleos de helio) en una delgada lámina de oro. El modelo atómico de Thomson predecía que la de las partículas alfa debían salir de la lámina con pequeñas desviaciones de sus trayectorias. Sin embargo, descubrió que algunas partículas se dispersan a grandes ángulos, e incluso completamente hacia atrás en algunos casos. Este descubrimiento en1911, llevó al modelo atómico de Rutherford, en que el átomo está constituido por protones y electrones. Así, el átomo del nitrógeno-14 estaría constituido por 14 protones y 7 electrones.1
El modelo de Rutherford funcionó bastante bien durante muchos años. Se pensaba que la repulsión de las cargas positivas entre protones era solventada por los electrones -con carga negativa- interpuestos ordenadamente en medio, por lo que el electrón era considerado como un "cemento nuclear".1 Esto fue hasta que los estudios llevados a cabo por Franco Rasetti, en el Institute of Technology de California en 1929. En 1925 se sabía que los protones y electrones tiene un espín de 1 / 2, y en el modelo de Rutherford nitrógeno - 14 los 14 protones y seis de los electrones deberían cancelar sus contribuciones al espín total, estimándose un espín total de 1 / 2. Rasetti descubierto, sin embargo, que el nitrógeno - 14 tiene un espín total unidad.2
En 1930 Wolfgang Pauli no pudo asistir a una reunión en Tubinga, y en su lugar envió una carta famoso con la clásica introducción "Queridos Señoras y señores radiactivos ". En su carta Pauli sugirió que tal vez existía una tercera partícula en el núcleo, que la bautizó con el nombre de "neutrones". Sugirió que era más ligero que un electrón y sin carga eléctrica, y que no interactuaba fácilmente con la materia (y por eso todavía no se le había detectado). Esta hipótesis permitía resolver tanto el problema de la conservación de la energía en la desintegración beta y el espín de nitrógeno - 14, la primera porque los neutrones llevaban la energía no detectada y el segundo porque un electrón extra se acoplaba con el electrón sobrante en el núcleo de nitrógeno - 14 para proporcionar un espín de 1. Enrico Fermi redenominó en 1931 los neutrones de Pauli como neutrinos (en italiano pequeño neutral) y unos treinta años después se demostró finalmente que un neutrinos realmente se emiten en el decaimiento beta.
En 1932 James Chadwick se dio cuenta de que la radiación que de que había sido observado por Walther Bothe, Herbert L. Becker, Irène y Jean Frédéric Joliot-Curie era en realidad debido a una partícula que él llamó el neutrón. En el mismo año Dimitri Ivanenko sugirió que los neutrones eran, de hecho partículas de espín 1 / 2, que existían en el núcleo y que no existen electrones en el mismo, y Francis Perrin sugirió que los neutrinos son partículas nucleares, que se crean durante el decaimiento beta. Fermi publicó1934 una teoría de los neutrinos con una sólida base teórica. En el mismo año Hideki Yukawa propuso la primera teoría importante de la fuerza para explicar la forma en que el núcleo mantiene junto.
Luego del descubrimiento del neutrón, por James Chadwick, Werner Heisenberg (que enunció años antes el principio de incertidumbre), indicó que los neutrones pueden ser parte del núcleo, y no así los electrones. Con esta teoría se resolvía totalmente el problema del spin que no coincidía, además de explicar todos los aspectos del comportamiento nuclear.2
Sin embargo, la nueva teoría traía consigo otro severo problema: con el modelo anterior, que incluía electrones como "cemento nuclear", se explicaba que los protones, todos con la misma carga positiva, permanecieran totalmente juntos, sin que saliesen disparados por la repulsión de cargas iguales. Sin embargo, con el modelo que incluye el neutrón, no había explicación alguna respecto a la forma en que en núcleo se mantiene unido y no explota de inmediato (es decir, ningún elemento debería existir, con la única excepción del hidrógeno). Para ejemplificar, la fuerza con la que se repelen dos protones a la distancia que están (una diezbillonésima de centímetro), es de aproximadamente 240 newtons, fuerza suficiente para elevar en el aire un objeto de algo más de 24 kilogramos (nótese la enormidad inimaginable de esa fuerza dado que estamos hablando de dos protones, cuya masa es de algo más de 10-27 kilogramos)3
La enorme dificultad que sufría la teoría se fue resolviendo gradualmente. En 1927, Heisenberg propuso el principio de incertidumbre, que indica que mientras mayor sea la precisión con que conozcamos la velocidad de una partícula, con menor precisión podremos conocer su posición.4
En 1930 Einstein dedujo a partir de este principio, por medios matemáticos, que si el principio es correcto, también es correcto otro tipo de indeterminación sobre la medición de la energía existente en un sistema cerrado. Mientras menor sea el lapso de tiempo en el cual se quiere saber la cantidad de energía del sistema, con menor precisión se la podrá medir.3
Al momento de sugerir el modelo de núcleo protón-neutrón, en 1932, Heisenberg sugirió también la existencia de un campo de fuerza que unía los protones, por medio de la existencia efímera de una partícula. La existencia de esta partícula sería posible sólo por el principio de incertidumbre, en la versión enunciada por Einstein.5
El físico japonés, Hideki Yukawa, entonces se puso a analizar las propiedades de la partícula propuesta por Heisenberg, y en 1935 describió esas propiedades con precisión. La partícula sólo podría existir un instante de unos 5 × 10-24 segundos, tiempo suficiente para que pueda ir de un protón a otro, pero no más allá del núcleo del átomo. La energía necesaria para la existencia de esta partícula en ese breve periodo se ajusta al principio de incertidumbre en la versión de Einstein.5 Utilizando esas ecuaciones, la energía disponible en ese periodo sería de 20 pJ (pico julios, 2 × 10-11 J o 1,25 × 108 eV), lo que equivale a una partícula con una masa de 250 veces la del electrón.
Desde entonces hubo varios intentos de detectar esa partícula experimentalmente. Por supuesto que siendo una partícula que sólo existe un breve instante, y utilizando energía no disponible, sólo gracias al principio de incertidumbre, sería imposible de detectar, excepto si esa energía fuese proporcionada. Los rayos cósmicos -partículas que llegan del espacio a enormes velocidades- pueden proporcionar esa energía. En 1948, experimentando con rayos cósmicos en Bolivia, la partícula fue detectada por Cecil Frank Powell. La partícula fue llamada Pion.6
Descripción del núcleo
Forma y tamaño del núcleo
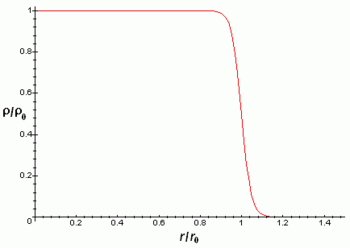
Los núcleos atómicos son mucho más pequeños que el tamaño típico de un átomo (entre 10 mil y 100 mil veces más pequeños). Además contienen más del 99% de la masa con lo cual la densidad másica del núcleo es muy elevada. Los núcleos atómicos tienen algún tipo de estructura interna, por ejemplo los neutrones y protones parecen estar orbitando unos alrededor de los otros, hecho que se manifiesta en la existencia del momento magnético nuclear. Sin embargo, los experimentos revelan que el núcleo se parece mucho a una esfera o elipsoide compacto de 10-15 m (= 1 fm), en el que la densidad parece prácticamente constante. Naturalmente el radio varía según el número de protones y neutrones, siendo los núcleos más pesados y con más partículas algo más grandes. La siguiente fórmula da el radio del núcleo en función del número de nucleones A:
Donde
La densidad de carga eléctrica del núcleo es aproximadamente constante hasta la distancia y luego decae rápidamente hasta prácticamente 0 en una distancia de acuerdo con la fórmula:
Donde r es la distancia radial al centro del núcleo atómico.
Las aproximaciones anteriores son mejores para núcleos esféricos, aunque la mayoría de núcleos no parecen ser esféricos como revela que posean momento cuadrupolar diferente de cero. Este momento cuadrupolar se manifiesta en la estructura hiperfina de los espectros atómicos y hace que el campo eléctrico del núcleo no sea un campo coulombiano con simetría esférica.
Estabilidad del núcleo
Los núcleos atómicos se comportan como partículas compuestas a energías suficientemente bajas. Además, la mayoría de núcleos atómicos por debajo de un cierto peso atómico y que además presentan un equilibrio entre el número de neutrones y el número de protones (número atómico) son estables. Sin embargo, sabemos que los neutrones aislados y los núcleos con demasiados neutrones (o demasiados protones) son inestables o radiactivos.
La explicación de esta estabilidad de los núcleos reside en la existencia de los piones. Aisladamente los neutrones pueden sufrir vía interacción débil la siguiente desintegración:
(1)
Sin embargo, dentro del núcleo atómico la cercanía entre neutrones y protones hace que sean mucho más rápidas, víainteracción fuerte las reacciones:
(2)
Esto hace que continuamente los neutrones del núcleo se transformen en protones, y algunos protones en neutrones, esto hace que la reacción () apenas tenga tiempo de acontecer, lo que explica que los neutrones de los núcleos atómicos sean mucho más estable que los neutrones aislados. Si el número de protones y neutrones se desequilibra, se abre la posibilidad de que en cada momento haya más neutrones y sea más fácil la ocurrencia de la reacción ().
Modelos de estructura del núcleo atómico
En 1808 el químico inglés John Dalton propone una nueva teoría sobre la constitución de la materia. Según Dalton toda la materia está formada por átomos indivisibles e invisibles, estos a su vez se unen para formar compuestos en proporciones enteras fijas y constantes. De hecho Dalton propuso la existencia de los átomos como una hipótesis para explicar porqué los átomos sólo se combinaban en ciertas combinaciones concretas. El estudio de esas combinaciones le llevó a poder calcular los pesos atómicos. Para Dalton la existencia del núcleo atómico era desconocida y se consideraba que no existían partes más pequeñas.
En 1897 Joseph John Thomson fue el primero en proponer un modelo estructural interno del átomo. Thomson fue el primero en identificar el electrón como partícula subatómica de carga negativa y concluyó que «si los átomos contienen partículas negativas y la materia se presenta con neutralidad de carga, entonces deben existir partículas positivas». Es así como Thomson postuló que el átomo debe ser una esfera compacta positiva en la cual se encontrarían incrustados los electrones en distintos lugares, de manera que la cantidad de carga negativa sea igual a la carga positiva.
Así ni el modelo atómico de Dalton ni el de Thomson incluían ninguna descripción del núcleo atómico. La noción de núcleo atómico surgió en 1911 cuando Ernest Rutherford y sus colaboradores Hans Geiger y Ernest Marsden, utilizando un haz de radiación alfa, bombardearon hojas laminadas metálicas muy delgadas, colocando una pantalla de sulfuro de zinc a su alrededor, sustancia que tenía la cualidad de producir destellos con el choque de las partículas alfa incidentes. La hoja metálica fue atravesada por la mayoría de las partículas alfa incidentes; algunas de ellas siguieron en línea recta, otras fueron desviadas de su camino, y lo más sorprendente, muy pocas rebotaron contra la lámina.
A la luz de la fórmula dispersión usada por Rutherford:
(1)
Donde:
- , siendo la constante dieléctrica del vacío y , es la carga eléctrica del centro dispersor.
- , es la energía cinética inicial de la partícula alfa incidente.
- es el parámetro de impacto.
Los resultados del experimento requerían parámetros de impacto muy pequeños, y por tanto que el núcleo estuviera concentrado en la parte central, el núcleo de carga positiva, donde estaría concentrada la masa del átomo. con ello explicaba la desviación de las partículas alfa (partículas de carga positiva). Los electrones se encontrarían en una estructura externa girando en órbitas circulares muy alejadas del núcleo, lo que explicaría el paso mayoritario de las partículas alfa a través de la lámina de oro.
En 1913 Niels Bohr postula que los electrones giran a grandes velocidades alrededor del núcleo atómico. Los electrones se disponen en diversas órbitas circulares, las cuales determinan diferentes niveles de energía. El electrón puede acceder a un nivel de energía superior, para lo cual necesita "absorber" energía. Para volver a su nivel de energía original es necesario que el electrón emita la energía absorbida (por ejemplo en forma de radiación).
Comúnmente existen dos modelos diferentes describir el núcleo atómico:
- El modelo de la gota de agua
- El modelo de capas
Aunque dichos modelos son mutuamente excluyentes en sus hipótesis básicas tal como fueron formulados originalmente, A. Bohr y Mottelson construyeron un modelo mixto que combinaba fenomenológicamente características de ambos modelos.
Modelo de la gota líquida
Este modelo no pretende describir la compleja estructura interna del núcleo sino sólo las energías de enlace entre neutrones y protones así como algunos aspectos de los estados excitados de un núcleo atómico que se reflejan en los espectros nucleares. Fue inicialmente propuesto por Bohr (1935) y el núcleo en analogía con una masa de fluido clásico compuesto por neutrones y protones y una fuerza central coulombiana repulsiva proporcional al número de protones Z y con origen en el centro de la gota.
Desde el punto de vista cuantitativo se observa que la masa de un núcleo atómico es inferior a la masa de los componentes indiviudales (protones y neutrones) que lo forman. Esta no conservación de la masa está conectada con la ecuación de Einstein, por la cual parte de la masa está en forma de energía de ligazón entre dichos componentes. Cuantiativamente se tiene la siguiente ecuación:7
Donde:
- son respectivamente la masa del núcleo, la masa de un protón y la masa de un neutrón.
- son respectivamente el número atómico (que coincide con el número de protones), el número másico (que coincide con el número de nucleones) y A-Z por tanto coincide con el número de neturones.
- es la energía de enlace entre todos los nucleones.
El modelo de la gota de agua pretende describir la energía de enlace B a partir de consideraciones geométricas e interpreta la energía de los estados excitados de los núcleos como rotaciones o vibraciones semiclásicas de la "gota de agua" que representa el núcleo. En concreto en este modelo la energía de enlace se representa como B:8
Donde:
- este término representa el efecto favorable del volumen.
- este término representa el efecto desfavorable de la superficie.
- representa el efecto de la repulsión coulombiana entre protones.
- representa el hecho de que los núcleos "equilibrados" con un número similar de protones y neutrones son más estables.
- representa el hecho de que los núcleos con un número par de protones y neutrones, son más estables que los que tienen un número impar de ambas especies. Matemáticamente el término viene dado por:
Modelo de capaas
Este es un modelo que trata de capturar parte de la estructura interna reflejada tanto en el momento angular del núcleo, como en su momento angular. Además el modelo pretende explicar porqué los núcleos con un "número mágico" de nucleones (neutrones y protones) resultan más estables (los números mágicos son 2, 8, 20, 28, 50, 82 y 126).
La explicación del modelo es que los nucleones se agrupan en "capas". Cada capa está formada por un conjunto de estados cuánticos con energías similares, la diferencia de energía entre dos capa es grande comparada con las variaciones de energía dentro de cada capa. Así dado que los nucleones son fermiones un núcleo atómico tendrá las capas de menor energía llena por lo que los nucleones no pueden caer a capas inferiores ya llenas. Las capas aquí deben entenderse en un sentido abstracto y no como capas físicas como las capas de una cebolla, de hecho la forma geométrica del espacio ocupado por un nucleón en un determinado estado de una capa se interpenetra con el espacio ocupado por nucleones de otras capas, de manera análoga a como las capas electrónicas se interpenetran en un átomo.
El núcleo atómico és la pequeña parte central delátomo, con carga eléctrica positiva y en la que se concentra la mayor parte de la masa del átomo.
Las principales partículas subatómicas de los núcleos de los átomos són los protones y losneutrones o los nucleones (excepto el del hidrógeno ordinario o protio, que contiene únicamente un protón). Un mismo elemento químico está caracterizado por el el número de protones del núcleo que determina la carga positiva total. Éste número se denomina número atómico. El número másico es el total de protones y neutrones.
Núcleo Atómico
| ||||||
Núcleo Atómico. Es una pequeña región central del átomo donde se encuentran distribuidos losneutrones y protones, partículas fundamentales del núcleo, que reciben el nombre de nucleones. La estabilidad del núcleo no puede explicarse por su acción eléctrica. Al contrario, la repulsión existente entre los protones produciría su desintegración. El hecho de que en el núcleo existan neutrones y protones es un indicador de que debe existir otra interacción más fuerte que la electromagnética que no está directamente relacionada con cargas eléctricas y que es mucho más intensa. Esta interacción se llama interacción nuclear fuerte y es la que predomina en el núcleo.
Para explicar la naturaleza de las fuerzas nucleares que mantienen unidas a las partículas dentro de los núcleos, es necesario analizar sus propiedades. En general, un núcleo tiene masa y está cargado eléctricamente. Además, tiene un tamaño que se puede medir por su radio. Los nucleones se mueven bajo la acción de sus interacciones mutuas y la intensidad de sus interacciones se puede medir por suenergía de enlace o energía de ligadura nuclear.
Contenido
[ocultar]Reseña histórica
El primer indicio que llevaría al establecimiento de la existencia del núcleo atómico fue el descubrimiento de la radiactividad por Antoine Henri Becquerel en 1896. Éste observó que las sales de Uranioemitían unas radiaciones que eran capaces de velar placas fotográficas en la oscuridad e incluso atravesar placas de Aluminio yCobre. Los esposos Curie descubren otros elementos que también son emisores radiactivos, aún más activos que el Uranio, como son elPolonio y el Radio.
A mitades del siglo XX fue cuando los físicos empezaron a notar que el comportamiento de los cuerpos a escala subatómica no era el mismo que el de los planetas en un sistema solar, por ello casi simultáneamente a la Teoria de la Relatividad se estaba desarrollando la mecanica cuantica para explicar el comportamiento de los átomos y de las partículas subatómicas.
Más tarde, en 1900, Ernest Rutherford y Paul U. Villard identifican en las radiaciones emitidas tres componentes distintos: unas partículas positivas, unas negativas o electrones, ya descubiertos anteriormente por J. J. Thomson y una radiación electromagnética sin carga eléctrica, con una corta longitud de onda.
Todos estos hechos llevan a Marie Curie a escribir en 1903:
«El átomo, indivisible desde el punto de vista químico, es divisible en este caso (refiriéndose a los procesos radiactivos), y los subátomos se encuentran en movimiento. La materia radiactiva experimenta, pues, una transformación química que es fuente de la energía radiada; pero no es una transformación química ordinaria, porque las transformaciones químicas dejan al átomo invariable.»
Rutherford, que con la ayuda de Frederick Soddy esboza las familias radiactivas, y tras recibir el premio Nobel de Química en 1908, es quien establece la existencia del núcleo del átomo. Ernest Rutherford propone un átomo que tenga un núcleo, donde esté concentrada la mayor parte de la masa del átomo y se encuentre la carga positiva, rodeado de electrones. Fue de nuevo Rutherford quien, en 1919, propuso que en los núcleos había protones (o lo que él llamaba partículas primeras) identificándolos con núcleos de Hidrógeno. Tras varios experimentos llevó a cabo en 1919 las primeras reacciones nucleares o transmutaciones de un núcleo en otro, utilizando partículas alfa naturales.
Heisenberg, en 1932, propone que el núcleo está formado por dos tipos de partículas: los protones y los neutrones (llamados colectivamente nucleones). Los protones tienen carga positiva e, igual y opuesta a la del electrón, y los neutrones son neutros eléctricamente. Si Z es el número atómico de un elemento, hay Z electrones en la corteza de su átomo y su núcleo tiene N neutrones, siendo A = Z + N el número de nucleones, también llamado número másico.
- Número atómico (Z): Es el número de protones que componen el núcleo del átomo. Así, el Hidrógeno (símbolo H), que es el átomo utilizado en la fusión nuclear, tiene un número Z=1, pues solamente dispone de un protón en su núcleo. De hecho, el hidrógeno es el elemento químico más sencillo —y a la vez más abundante en la naturaleza—.
- Masa atómica (A): Es la suma de protones y neutrones. También se llama número másico. Considerando N al número de neutrones de un átomo, tenemos que A = Z + N.
- Peso atómico: Es el peso del átomo, tomando como unidad la duodécima parte del peso del átomo de Carbono (C). Así, el Hidrógeno pesa aproximadamente 1 y el Carbono 12.
- Isótopo: Un mismo tipo de átomo puede tener en su núcleo distinto número de neutrones. A cada variedad se le llama isótopo. Así, como se ve en el gráfico de abajo, el hidrógeno tiene tres isótopos diferentes: isótopo hidrógeno, isótopo deuterio e isótopo tritio. Estos dos últimos son los utilizados en la fusión nuclear.
Características de los núcleos atómicos
Los núcleos atómicos tienen distintas formas geométricas, con tamaños del orden de varios fermis (10-15m). Al ser de tan pequeño tamaño, la materia está muy concentrada en los núcleos, con densidades muy altas (del orden de 1018 kg/m3). Esta densidad no depende del número másico A, los cual nos indica que su volumen es proporcional a A (pues para ser constante la densidad al crecer la masa A también ha de crecer el volumen proporcionalmente), y su radio, asimilando el núcleo a una esfera, a la raíz cúbica de A. De hecho muchos experimentos indican que el radio nuclear vale: R = R0 * A1/3
Donde R0 toma un valor aproximado de 1,2 fermis.
Por tanto, el volumen de un núcleo si se considera su forma esférica, es proporcional al número A de nucleones, y la densidad nuclear es un valor constante, 1015 veces mayor que la densidad de la materia macroscópica, lo que da una idea de la gran compacidad de los nucleones dentro de un núcleo. Así mismo, demuestra que la materia macroscópica está esencialmente vacía, ya que la mayor parte de la masa está concentrada en los núcleos.
Estabilidad nuclear
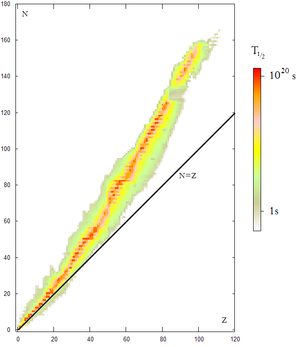
Un núcleo se considera estable si no se transmuta espontáneamente en 1021 años, si bien puede transmutarse en otros núcleos bajo ciertas condiciones. Hay 115 elementos químicos conocidos, de los cuales, 92 existen en la naturaleza y el resto han sido obtenido artificialmente. Se conocen hoy en día unos 2000 núclidos, de los cuales son estables 274. Unos 340 existen en la Naturaleza y el resto se han producido en el laboratorio. Por tanto, la mayoría de los núclidos son radiactivos.
Los núclidos radiactivos son inestables y se transforman espontáneamente con el tiempo formando otros núclidos.
Energía de enlace nuclear
Se define como la energía necesaria para separar los nucleones de un núcleo, o bien como la energía que se libera cuando se unen los nucleones para formar el núcleo.
El origen de la energía de ligadura o de enlace nuclear reside en la desaparición de una parte de la masa de los nucleones que se combinan para formar el núcleo. Esta diferencia de masa recibe el nombre de defecto másico Dm, y se transforma en energía cuyo cálculo se puede realizar por la ecuación deEinstein, E=mc2
Si a la suma de las masas de los nucleones y electrones de un átomo le restamos la masa medida experimentalmente a través del espectrógrafo de masas, obtenemos el defecto másico, y podemos calcular la energía total de enlace. La energía de enlace o de ligadura será equivalente a la energía liberada en la formación de un núcleo.
La u.m.a. se define como la doceava parte de la masa del átomo 612C y 1 u.m.a.=1'66.10-27 Kg, sustituyendo en la ecuación de Einstein, E=mc2,se obtiene E=931 MeV, es decir, 1 u.m.a. libera 931 MeV. Por tanto, la energía liberada (Ee) en la formación de un núcleo será:
Ee = Dm × 931 MeV.
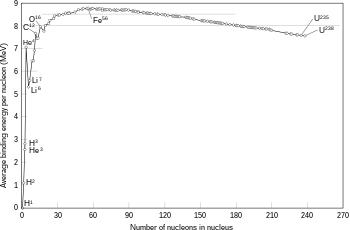
La energía de enlace por nucleón se obtiene dividiendo la energía de enlace del núcleo por sus A nucleones.
Si bien en los núcleos livianos se observa un aumento abrupto de la energía de enlace por nucleón frente al número másico A, a partir de A=10, la energía de enlace por nucleón es prácticamente constante.
El máximo corresponde a núcleos semipesados con A=62 (Fe, Co, Ni), donde las fuerzas de atracción serán máximas. El decrecimiento de la energía para A>60 se debe a la repulsión eléctrica entre los protones cuyo número va aumentando y reduce por tanto la estabilidad de los núcleos. En los núcleos ligeros, cada nucleón es atraído por pocos nucleones, lo que también reduce su estabilidad.
Características de las fuerzas nucleares
- Las fuerzas nucleares son fuerzas atractivas de gran intensidad dado el tamaño de los núcleos y su enorme densidad, que predominan en el núcleo venciendo la repulsión electrostática entre los protones.
- Son de corto alcance, es decir, cada nucleón interacciona con los nucleones más próximos, si bien a distancias muy cortas, las fuerzas nucleares se hacen repulsivas lo que explica que los nucleones permanezcan a distancias medias constantes y que el volumen por nucleón sea constante.
- La fuerza de interacción entre dos nucleones es independiente de la carga, por lo que la fuerza entre dos nucleones, bien sean protón-protón, neutrón-neutrón o protón-neutrón, es aproximadamente la misma. Radiactividad
- La radiactividad o radioactividad1 es un fenómeno físico por el cual los núcleos de algunos elementos químicos, llamados radiactivos, emiten radiaciones que tienen la propiedad de impresionar placas radiográficas, ionizar gases, producirfluorescencia, atravesar cuerpos opacos a la luz ordinaria, entre otros. Debido a esa capacidad, se les suele denominarradiaciones ionizantes (en contraste con las no ionizantes). Las radiaciones emitidas pueden ser electromagnéticas, en forma de rayos X o rayos gamma, o bien corpusculares, como pueden ser núcleos de helio, electrones o positrones,protones u otras. En resumen, es un fenómeno que ocurre en los núcleos de ciertos elementos inestables, que son capaces de transformarse o decaer, espontáneamente, en núcleos atómicos de otros elementos más estables.La radiactividad ioniza el medio que atraviesa. Una excepción la constituye el neutrón, que posee carga neutra (igual carga positiva como negativa), pero ioniza la materia en forma indirecta. En las desintegraciones radiactivas se tienen varios tipos de radiación: alfa, beta, gamma y neutrones libres.La radiactividad es una propiedad de los isótopos que son "inestables", es decir, que se mantienen en un estado excitado en sus capas electrónicas o nucleares, con lo que, para alcanzar su estado fundamental, deben perder energía. Lo hacen en emisiones electromagnéticas o en emisiones de partículas con una determinada energía cinética. Esto se produce variando la energía de sus electrones (emitiendo rayos X) o de sus nucleones (rayo gamma) o variando el isótopo (al emitir desde el núcleo electrones, positrones, neutrones, protones o partículas más pesadas), y en varios pasos sucesivos, con lo que un isótopo pesado puede terminar convirtiéndose en uno mucho más ligero, como el uranio que, con el transcurrir de los siglos, acaba convirtiéndose en plomo.La radiactividad se aprovecha para la obtención de energía nuclear, se usa en medicina (radioterapia y radiodiagnóstico) y en aplicaciones industriales (medidas de espesores y densidades, entre otras).La radiactividad puede ser:
- Natural: manifestada por los isótopos que se encuentran en la naturaleza.
- Artificial o inducida: manifestada por los radioisótopos producidos en transformaciones artificiales.
Radiactividad natural[
En 1896 Henri Becquerel descubrió que ciertas sales de uranio emiten radiaciones espontáneamente, al observar que velaban las placas fotográficas envueltas en papel negro. Hizo ensayos con el mineral en caliente, en frío, pulverizado, disuelto en ácidos y la intensidad de la misteriosa radiación era siempre la misma. Por tanto, esta nueva propiedad de la materia, que recibió el nombre de radiactividad, no dependía de la forma física o química en la que se encontraban los átomos del cuerpo radiactivo, sino que era una propiedad que radicaba en el interior mismo del átomo.El estudio del nuevo fenómeno y su desarrollo posterior se debe casi exclusivamente al matrimonio de Marie y Pierre Curie, quienes encontraron otras sustancias radiactivas: eltorio, el polonio y el radio. La intensidad de la radiación emitida era proporcional a la cantidad de uranio presente, por lo que los Curie dedujeron que la radiactividad era una propiedad atómica. El fenómeno de la radiactividad se origina exclusivamente en el núcleo de los átomos radiactivos. Se cree que se origina debido a la interacción neutrón-protón. Al estudiar la radiación emitida por el radio, se comprobó que era compleja, pues al aplicarle un campo magnético parte de ella se desviaba de su trayectoria y otra parte no.Pronto se vio que todas estas reacciones provienen del núcleo atómico que describió Ernest Rutherford en 1911, quien también demostró que las radiaciones emitidas por las sales de uranio pueden ionizar el aire y producir la descarga de cuerpos cargados eléctricamente.Con el uso del neutrón, partícula teorizada en 1920 por Ernest Rutherford, se consiguió describir la radiación beta.En 1932, James Chadwick descubrió la existencia del neutrón que Rutherford había predicho en 1920, e inmediatamente después Enrico Fermi descubrió que ciertas radiaciones emitidas en fenómenos no muy comunes de desintegración son en realidad neutrones.Radiactividad artificial
La radiactividad artificial, también llamada radiactividad inducida, se produce cuando se bombardean ciertos núcleos estables con partículas apropiadas. Si la energía de estas partículas tiene un valor adecuado, penetran el núcleo bombardeado y forman un nuevo núcleo que, en caso de ser inestable, se desintegra después radiactivamente. Fue descubierta por la pareja Jean Frédéric Joliot-Curie eIrène Joliot-Curie, bombardeando núcleos de boro y de aluminio con partículas alfa. Observaron que las sustancias bombardeadas emitían radiaciones (neutrones libres) después de retirar el cuerpo radiactivo emisor de las partículas de bombardeo. El plomo es la sustancia que mayor fuerza de impenetracion posee por parte de los rayos x y gamma.En 1934 Fermi se encontraba en un experimento bombardeando núcleos de uranio con los neutrones recién descubiertos. En 1938, enAlemania, Lise Meitner, Otto Hahn y Fritz Strassmann verificaron los experimentos de Fermi. En 1939 demostraron que una parte de los productos que aparecían al llevar a cabo estos experimentos era bario. Muy pronto confirmaron que era resultado de la división de los núcleos de uranio: la primera observación experimental de la fisión. En Francia, Jean Frédéric Joliot-Curie descubrió que, además del bario, se emiten neutrones secundarios en esa reacción, lo que hace factible la reacción en cadena.También en 1932, Mark Lawrence Elwin Oliphant2 teorizó sobre la fusión de núcleos ligeros (de hidrógeno), y poco después Hans Bethedescribió el funcionamiento de las estrellas con base en este mecanismo.El estudio de la radiactividad permitió un mayor conocimiento de la estructura del núcleo atómico y de las partículas subatómicas. Se abrió la posibilidad de convertir unos elementos en otros. Incluso se hizo realidad el ancestral sueño de los alquimistas de crear oro a partir de otros elementos, como por ejemplo átomos de mercurio, aunque en términos prácticos el proceso de convertir mercurio en oro no resulta rentable debido a que el proceso requiere demasiada energía.El 15 de marzo de 1994, la Agencia Internacional de la Energía Atómica (AIEA) dio a conocer un nuevo símbolo de advertencia de radiactividad con validez internacional. La imagen fue probada en 11 países.Clases y componentes de la radiación
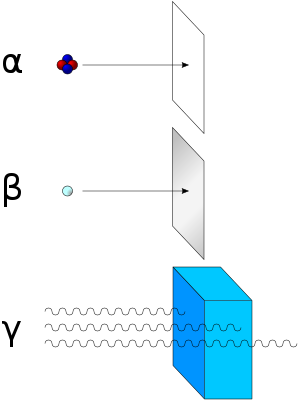
Se comprobó que la radiación puede ser de tres clases diferentes, conocidas como partículas, desintegraciones y radiación:- Partícula alfa: Son flujos de partículas cargadas positivamente compuestas por dos neutrones y dos protones (núcleos de helio). Son desviadas por campos eléctricos y magnéticos. Son poco penetrantes, aunque muy ionizantes. Son muy energéticas. Fueron descubiertas por Rutherford, quien hizo pasar partículas alfa a través de un fino cristal y las atrapó en un tubo de descarga. Este tipo de radiación la emiten núcleos de elementos pesados situados al final de latabla periódica (masa A >100). Estos núcleos tienen muchos protones y la repulsión eléctrica es muy fuerte, por lo que tienden a obtener N aproximadamente igual a Z (número atómico), y para ello se emite una partícula alfa. En el proceso se desprende mucha energía, que se convierte en la energía cinética de la partícula alfa, por lo que estas partículas salen con velocidades muy altas.
- Desintegración beta: Son flujos de electrones (beta negativas) o positrones (beta positivas) resultantes de la desintegración de los neutrones o protones del núcleo cuando este se encuentra en un estado excitado. Es desviada por campos magnéticos. Es más penetrante, aunque su poder de ionización no es tan elevado como el de las partículas alfa. Por lo tanto, cuando un átomo expulsa una partícula beta, su número atómico aumenta o disminuye una unidad (debido al protón ganado o perdido). Existen tres tipos de radiación beta: la radiación beta-, que consiste en la emisión espontánea de electrones por parte de los núcleos; la radiación beta+, en la que un protón del núcleo se desintegra y da lugar a un neutrón, a un positrón o partícula Beta+ y un neutrino, y por último la captura electrónica que se da en núcleos con exceso de protones, en la cual el núcleo captura un electrón de la corteza electrónica, que se unirá a un protón del núcleo para dar un neutrón.
- Radiación gamma: Se trata de ondas electromagnéticas. Es el tipo más penetrante de radiación. Al ser ondas electromagnéticas de longitud de onda corta, tienen mayor penetración y se necesitan capas muy gruesas de plomou hormigón para detenerlas. En este tipo de radiación el núcleo no pierde su identidad, sino que se desprende de la energía que le sobra para pasar a otro estado de energía más baja emitiendo los rayos gamma, o sea fotones muy energéticos. Este tipo de emisión acompaña a las radiaciones alfa y beta. Por ser tan penetrante y tan energética, éste es el tipo más peligroso de radiación.
Las leyes de desintegración radiactiva, descritas por Frederick Soddy y Kasimir Fajans, son:- Cuando un átomo radiactivo emite una partícula alfa, la masa del átomo (A) resultante disminuye en 4 unidades y el número atómico (Z) en 2.
- Cuando un átomo radiactivo emite una partícula beta, el número atómico (Z) aumenta o disminuye en una unidad y la masa atómica (A) se mantiene constante.
- Cuando un núcleo excitado emite radiación gamma, no varía ni su masa ni su número atómico: sólo pierde una cantidad de energía hν (donde "h" es la constante de Plancky "ν" es la frecuencia de la radiación emitida).
Las dos primeras leyes indican que, cuando un átomo emite una radiación alfa o beta, se transforma en otro átomo de un elemento diferente. Este nuevo elemento puede ser radiactivo y transformarse en otro, y así sucesivamente, con lo que se generan las llamadas series radiactivas.Causa de la radiactividad
En general son radiactivas las sustancias que no presentan un balance correcto entre protones o neutrones, tal como muestra el gráfico que encabeza este artículo. Cuando el número de neutrones es excesivo o demasiado pequeño respecto al número de protones, se hace más difícil que la fuerza nuclear fuerte debido al efecto del intercambio depiones pueda mantenerlos unidos. Eventualmente, el desequilibrio se corrige mediante la liberación del exceso de neutrones o protones, en forma de partículas α que son realmente núcleos de helio, y partículas β, que pueden ser electrones o positrones. Estas emisiones llevan a dos tipos de radiactividad, ya mencionados:- Radiación α, que aligera los núcleos atómicos en 4 unidades másicas, y cambia el número atómico en dos unidades.
- Radiación β, que no cambia la masa del núcleo, ya que implica la conversión de un protón en un neutrón o viceversa, y cambia el número atómico en una sola unidad (positiva o negativa, según si la partícula emitida es un electrón o un positrón).
La radiación γ, por su parte, se debe a que el núcleo pasa de un estado excitado de mayor energía a otro de menor energía, que puede seguir siendo inestable y dar lugar a la emisión de más radiación de tipo α, β o γ. La radiación γ es, por tanto, un tipo de radiación electromagnética muy penetrante, ya que tiene una alta energía por fotón emitido.Período de semidesintegración radiactiva
La desintegración radiactiva se comporta en función de la ley de decaimiento exponencial:donde:- es el número de radionúclidos existentes en un instante de tiempo .
- es el número de radionúclidos existentes en el instante inicial .
- , llamada constante de desintegración radiactiva, es la probabilidad de desintegración por unidad de tiempo. A partir de la definición de actividad (ver Velocidad de desintegración), es evidente que la constante de desintegración es el cociente entre el número de desintegraciones por segundo y el número de átomos radiactivos ().
Se llama tiempo de vida o tiempo de vida media de un radioisótopo el tiempo promedio de vida de un átomo radiactivo antes de desintegrarse. Es igual a la inversa de la constante de desintegración radiactiva ().Al tiempo que transcurre hasta que la cantidad de núcleos radiactivos de un isótopo radiactivo se reduzca a la mitad de la cantidad inicial se le conoce como periodo de semidesintegración, período, semiperiodo, semivida o vida media (no confundir con el ya mencionado tiempo de vida) (). Al final de cada período, la radiactividad se reduce a la mitad de la radiactividad inicial. Cada radioisótopo tiene un semiperiodo característico, en general diferente del de otros isótopos.Ejemplos:Isótopo Periodo Emisión Uranio-238 4510 millones de años Alfa Carbono-14 5730 años Beta Cobalto-60 5,271 años Gamma Radón-222 3,82 días Alfa Velocidad de desintegración
La velocidad de desintegración o actividad radiactiva se mide en Bq, en el SI. Un becquerel vale 1 desintegración por segundo. También existen otras unidades: el rutherford, que equivale a 106 desintegraciones por segundo, o el curio, Ci, que equivale idénticamente a 3,7·1010 desintegraciones por segundo (unidad basada en la actividad de 1 g de226Ra que es cercana a esa cantidad). Empíricamente se ha determinado que la velocidad de desintegración es la tasa de variación del número de núcleos radiactivos por unidad de tiempo:Dada la ley de desintegración radiactiva que sigue (ver Periodo de semidesintegración), es evidente que:,donde:- es la actividad radiactiva en el instante .
- es la actividad radiactiva inicial (cuando ).
- es la base de los logaritmos neperianos.
- es el tiempo transcurrido.
- es la constante de desintegración radiactiva propia de cada radioisótopo.
La actividad también puede expresarse en términos del número de núcleos a partir de su propia definición. En efecto:Contador Geiger
Un contador Geiger es un instrumento que permite medir la radiactividad de un objeto o lugar. Cuando una partícula radiactiva se introduce en un contador Geiger, produce un breve impulso de corriente eléctrica. La radiactividad de una muestra se calcula por el número de estos impulsos. Está formado, normalmente, por un tubo con un fino hilo metálico a lo largo de su centro. El espacio entre ellos está aislado y relleno de un gas, y con el hilo a unos 1000 voltios relativos con el tubo. Un ion o electrón penetra en el tubo (o se desprende un electrón de la pared por los rayos X o gamma) desprende electrones de los átomos del gas y que, debido al voltaje positivo del hilo central, son atraídos hacia el hilo. Al hacer esto ganan energía, colisionan con los átomos y liberan más electrones, hasta que el proceso se convierte en un alud que produce un pulso de corriente detectable. Relleno de un gas adecuado, el flujo de electricidad se para por sí mismo o incluso el circuito eléctrico puede ayudar a pararlo. Al instrumento se le llama un "contador" debido a que cada partícula que pasa por él produce un pulso idéntico, permitiendo contar las partículas (normalmente de forma electrónica) pero sin decirnos nada sobre su identidad o su energía (excepto que deberán tener energía suficiente para penetrar las paredes del contador). Los contadores de Van Allen estaban hechos de un metal fino con conexiones aisladas en sus extremos.Riesgos para la salud
El riesgo para la salud no sólo depende de la intensidad de la radiación y de la duración de la exposición, sino también del tipo de tejido afectado y de su capacidad de absorción. Por ejemplo, los órganos reproductores son 50 veces más sensibles que la piel.Los efectos mutagénicos de la radiación fueron identificados por primera vez por Hermann Joseph Muller en 1927. Por esta investigación le fue concedido el Premio Nobel de Medicina en 1946.Consecuencias para la salud de la exposición a las radiaciones ionizantes
Los efectos de la radiactividad sobre la salud son complejos. Dependen de la dosis absorbida por el organismo. Como no todas las radiaciones tienen la misma nocividad, se multiplica cada radiación absorbida por un coeficiente de ponderación para tener en cuenta las diferencias. Esto se llama dosis equivalente, que se mide en sieverts (Sv), ya que el becquerel, para medir la peligrosidad de un elemento, erróneamente considera idénticos los tres tipos de radiaciones (alfa, beta y gamma). Una radiación alfa o beta es relativamente poco peligrosa fuera del cuerpo. En cambio, es extremadamente peligrosa cuando se inhala. Por otro lado, las radiaciones gamma son siempre dañinas, puesto que se neutralizan con dificultad.Dosis aceptable de irradiación
Hasta cierto punto, las radiaciones naturales (emitidas por el medio ambiente) son inofensivas. El promedio de tasa de dosis equivalente medida a nivel del mar es de 0,00012 mSv/h (0,012 mrem/h).La dosis efectiva (suma de las dosis recibida desde el exterior del cuerpo y desde su interior) que se considera que empieza a producir efectos en el organismo de forma detectable es de 100 mSv (10 rem) en un periodo de 1 año.4Los métodos de reducción de la dosis son: 1) reducción del tiempo de exposición, 2) aumento del blindaje y 3) aumento de la distancia a la fuente radiante.A modo de ejemplo, se muestran las tasas de dosis en la actualidad utilizadas en una central nuclear para establecer los límites de permanencia en cada zona, el personal que puede acceder a ellas y su señalización:Zona Dosis Zona gris o azul de 0,0025 a 0,0075 mSv/h Zona verde de 0,0075 a 0,025 mSv/h Zona amarilla de 0,025 a 1 mSv/h Zona naranja de 1 a 100 mSv/h Zona roja > 100 mSv/h Dosis efectiva permitida
La dosis efectiva es la suma ponderada de dosis equivalentes en los tejidos y órganos del cuerpo procedentes de irradiaciones internas y externas. En la Unión Europea, la Directiva 96/29/EURATOM limita la dosis efectiva para trabajadores expuestos a 100 mSv durante un período de cinco años consecutivos, con una dosis efectiva máxima de 50 mSv en cualquier año, y existen otros límites concretos de dosis equivalentes en determinadas zonas del cuerpo, como el cristalino, la piel o las extremidades, además de límites concretos para mujeres embarazadas o lactantes. Para la población general, el límite de dosis efectiva es de 1 mSv por año, aunque en circunstancias especiales puede permitirse un valor de dosis efectiva más elevado en un único año, siempre que no se sobrepasen 5 mSv en cinco años consecutivos.5En el caso de intervenciones (emergencias radiológicas), sin embargo, estos límites no son aplicables. En su lugar se recomienda que, cuando puedan planificarse las acciones, se utilicen niveles de referencia. En estos casos, las actuaciones comienzan cuando la dosis al público puede superar los 10 mSv en dos días (permanencia en edificios). En cuanto a los trabajadores, se intentará que la dosis que reciban sea siempre inferior al límite anual, salvo en medidas urgentes (rescate de personas, situaciones que evitarían una dosis elevada a un gran número de personas, impedir situaciones catastróficas). En estos casos se intentará que no se supere el doble del límite de dosis en un solo año (100 mSv), excepto cuando se trate de salvar vidas, donde se pondrá empeño en mantener las dosis por debajo de 10 veces ese límite (500 mSv). Los trabajadores que participen en acciones que puedan alcanzar este nivel de 500 mSv deberán ser informados oportunamente y deberán ser voluntarios.6La dosis efectiva es una dosis acumulada. La exposición continua a las radiaciones ionizantes se considera a lo largo de un año, y tiene en cuenta factores de ponderación que dependen del órgano irradiado y del tipo de radiación de que se trate.La dosis efectiva permitida para alguien que trabaje con radiaciones ionizantes (por ejemplo, en una central nuclear o en un centro médico) es de 100 mSv en un periodo de 5 años, y no se podrán superar en ningún caso los 50 mSv en un mismo año. Para las personas que no trabajan con radiaciones ionizantes, este límite se fija en 1 mSv al año. Estos valores se establecen por encima del fondo natural (que en promedio es de 2,4 mSv al año en el mundo).Las diferencias en los límites establecidos entre trabajadores y otras personas se deben a que los trabajadores reciben un beneficio directo por la existencia de la industria en la que trabajan, y por tanto, asumen un mayor riesgo que las personas que no reciben un beneficio directo.Por ese motivo, para los estudiantes se fijan límites algo superiores a los de las personas que no trabajan con radiaciones ionizantes, pero algo inferiores a los de las personas que trabajan con radiaciones ionizantes. Para ellos se fija un límite de 6 mSv en un año.Además, esos límites se establecen en función de ciertas hipótesis, como es la del comportamiento lineal sin umbral de los efectos de las radiaciones ionizantes sobre la salud (el modelo LNT). A partir de este modelo, basado en medidas experimentales (de grandes grupos de personas expuestas a las radiaciones, como los supervivientes deHiroshima y Nagasaki) de aparición de cáncer, se establecen límites de riesgo considerado aceptable, consensuados con organismos internacionales tales como laOrganización Internacional del Trabajo (OIT), y a partir de esos límites se calcula la dosis efectiva resultante.Ley de la radiosensibilidad
La ley de la radiosensibilidad (también conocida como ley de Bergonié y Tribondeau, postulada en 1906) dice que los tejidos y órganos más sensibles a las radiaciones son los menos diferenciados y los que exhiben alta actividad reproductiva.Como ejemplo, tenemos:- Tejidos altamente radiosensibles: epitelio intestinal, órganos reproductivos (ovarios, testículos), médula ósea, glándula tiroides.
- Tejidos medianamente radiosensibles: tejido conectivo.
- Tejidos poco radiosensibles: neuronas, hueso.
Ejemplos de isótopos radiactivos[editar]
Isótopos naturales[editar]
Isótopos artificiales[editar]





No hay comentarios:
Publicar un comentario